
穩定細胞株作為生物制藥CMC的基礎工作,一向被重視和矚目,正所謂“成也蕭何,敗也蕭何”,一個好的細胞株往往能使得后續的工藝開發工作事半功倍,大幅降低抗體/重組蛋白的生產成本;反之則需要花費更多的時間去進行上游工藝的優化和改善,既延長了項目時間,又花費了更多的資金。今天的皓奇星欄目我們便來介紹一下細胞株構建的流程。
CHO細胞歷史悠久,并擁有龐大的家族。從1919年,北京協和醫學院的Dr. E.T. Hsieh 在北京郊外抓了一些中國倉鼠用作動物模型開始,一直到1948年12月,由美國醫生Robert Briggs Watson在協和醫學院的Cheng siang-Hu教授的協助下將20只中國倉鼠趕在南京解放前送到上海,并從上海運送到紐約,最后由Victor Schwentker公司馴養成一種實驗室動物品系,中國倉鼠一直作為一種實驗室研究用動物模型(想到這里筆者痛心疾首,要不是那時中國處于戰亂,自己沒有能力保存,也不至于今天被ATCC和ECACC掐住脖子)。后Puck成功分離到了中國倉鼠卵巢細胞并體外培養,在接下來的幾十年里CHO細胞家族不斷壯大,被廣泛應用于生物制藥領域。
Florian M. Wurm and Maria Jo?o Wurm.Cloning of CHO Cells, Productivity and Genetic Stability-A Discussion.
今天不同品系的CHO細胞被用于重組蛋白的表達,其中有代表性的包括:
不同的宿主細胞在細胞株構建中的表現差異很大,本文僅能從筆者有限的經驗中提供一些參考,對于初步涉及細胞株工作的朋友,可以采購商品化的宿主細胞試劑盒,并遵照說明書進行操作,熟悉細胞的特性后,再自行優化篩選方式。各種宿主細胞均有各自優劣,使用者需要考慮包括表達水平、蛋白質量、商業授權等各方面因素,例如優勢方面,GS系統下表達量和Qp相對較高,DG44系統細胞株穩定性好,K1 篩選周期短且表達量高,CHO-S商業授權清晰;反過來缺點方面GS系統價格昂貴,DG44表達量較低,K1細胞株穩定性較差,CHO-S相對易結團等等。真正有經驗的研究人員,則可以根據不同細胞的特性,開發合適的篩選方式和培養工藝,將細胞的潛能挖掘到最大,正如俗語所說“Less is more”,細胞株構建亦然。
生產用穩定細胞株的構建首先由表達載體的構建和細胞轉染開始
1、將表達抗體的目的基因構建到載體上,再將該載體轉染進入宿主細胞內,常見的轉染方式主要有鈣轉、電轉、脂質體轉染和逆轉錄病毒轉染,DNA進入宿主細胞核后將會隨機整合到宿主細胞基因組當中去,因此表達水平與基因拷貝數、基因整合位點的轉錄活性有關。
2、接下來不同篩選試劑將被用于篩選能夠正確表達目的基因并且高水平表達的細胞群(pool)。
3、由于此時得到的細胞群中的每個細胞特性各異,具有不同的基因整合位點、拷貝數、細胞單產和生長速率,因此需要將其中具有高產、穩定表達特性的細胞個體分離出來分別培養,通常需要獲得數百甚至上千的候選克隆供進一步篩選。
4、被篩選出來的克隆經過傳代培養和分批補料實驗(Fed-batch),比較其生長特性、代謝狀況、表達量高低、表達產物質量等,選出最優的幾個克隆進入生物反應器放大實驗,同步評估細胞株穩定性,最終確定生產用單克隆細胞株。
Soo Min Noh, Seunghyeon Shin and Gyun MinLee. Comprehensive characterization of glutamine synthetase-mediated selectionfor the establishment of recombinant CHO cells producing monoclonal antibodies.
篩選標記
為了有效地篩選出高表達的細胞,表達載體上除了包含抗體的重、輕鏈以外,往往還含有各種篩選標記,篩選標記一般可以被分為兩大類:一類是以G418為代表的抗生素類篩選標記,另一類是以MTX為代表的影響細胞代謝的篩選標記。與此同時,高效的啟動子(如CMV)和延長因子(如EF1α)被廣泛運用于抗體表達載體。翻譯的起始位置是恒定的Kozak序列:GCC GCC(A/C)CC和抗體特異性的信號肽——不同的重輕鏈類型有各自特異的信號肽序列。
位置效應
插入染色體的位置影響真核基因的表達,即“位置效應”。當外源基因插入異染色質及其附近區域產生位置效應時,此處異染色質區域將產生位置效應斑點,此時,周圍的異染色質將有效地阻止插入基因的表達。為了克服“位置效應”,一般有兩種辦法:1、將目的基因定點整合到合適的位點;2、在目的基因的側翼加上“絕緣子”DNA序列,從而抑制“位置效應”。
細胞群
當目的基因被轉染到宿主細胞內,并按照一定的細胞密度在合適的篩選壓力下進行傳代培養后便得到了細胞群(pool)。細胞群的表達量取決于轉染的方式、篩選壓力的作用以及目的基因整合情況 。由于不同的宿主細胞在篩選條件下的特性不同,針對不同的宿主細胞,可以采取不同的細胞群篩選方式,包括是搖瓶中大規模的細胞群的篩選還是孔版中的迷你細胞群的篩選,亦或是選擇合適的篩選壓力大小,目標是在較短的時間內能夠篩選得到表達量相對較高的細胞群。對于不同的項目,在細胞群階段需要考察的標準不同,對于常規新藥抗體,往往表達量會成為第一評價標準;對于生物類似物,則需在細胞群階段著重考察各項質量參數與原研的差異;對于雙特異性抗體,則需要在此階段就開始考察正確裝配的比例,從而降低克隆篩選階段的風險。
常用的篩選克隆的方法
有限稀釋法因為其低成本和易于操作,被廣泛運用于克隆的篩選。需要注意的是,為符合FDA的申報要求需進行兩輪LDC,且細胞密度<0.5細胞每孔或者一輪LDC結合圖像證明,以驗證單克隆性。有限稀釋法工作量大,往往需要運用自動化工作站進行高通量的篩選。
半固體培養基法進行單克隆的篩選。細胞生長在半固體培養中,形成單克隆細胞團,同時將抗體分泌在細胞團周圍,半固體培養基中含有熒光標記的二抗,能與抗體Fc片段特異性結合,當用一定波長的光進行激發時就能發出熒光。使用圖像分析軟件能夠對單克隆細胞團的大小、熒光強度進行測定,從而篩選出生長旺盛、表達量高的單克隆細胞團。自動化的機械臂能夠按照實驗人員設定的參數將符合要求的細胞團挑取出來用于后續的擴大培養。半固體培養基法能夠通過自動化的方式挑取單克隆細胞,大大減輕了實驗人員的工作負擔,但用于熒光掃描、圖像分析和克隆挑取的機器價格昂貴,且為符合申報要求,需要兩輪半固體培養基篩選或一輪半固體培養基篩選結合一輪LDC進行。
流式細胞儀分選法(FACS)。將帶有熒光標記的二抗和分泌抗體的CHO細胞混合孵育,分泌到細胞表面的抗體就能夠被流式細胞儀檢測到,從而利用其分選功能篩選出分泌多的細胞。為了使分泌到胞外的抗體能夠維持在細胞膜表面,還可以使用微囊將細胞以及分泌的抗體包裹起來。
克隆篩選工作往是微量、高通量,檢測和操作手段的改善和升級非常重要,如HTRF(均相時間分辨熒光),可以使用較小的樣品量(2.5-5.0μL)進行高通量(384孔板)檢測,結合自動化工作站的輔助,能夠大幅降低研發人員的工作量。
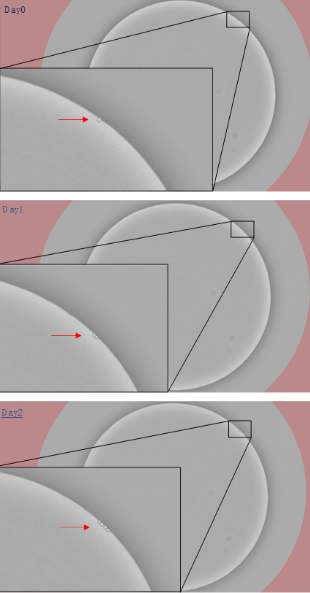
圖3.單克隆成像系統下單克隆細胞擴增的過程(使用MD CloneSelect Imager 拍攝)?
優秀的單克隆細胞株還要考慮到細胞生長、表達和代謝情況,以及目的蛋白的質量水平。要關注乳酸和氧的代謝,高乳酸和高耗氧可能為細胞株在反應器的培養埋下隱患。細胞株的工藝要考慮到未來反應器中培養的可重復和可放大性,同時選擇可及性較強,批次穩定的培養基和補料。培養基的價格跟用量高度相關,根據筆者的經驗,年使用量從100L提高到10000L,培養基的單價可以相差5-10倍,大規模使用時,進口商業化培養基的價格一般會處于100-200元/升,而假如擁有自己的CD培養基配方,委托GE、Merck或者Thermo等生產,其價格則會進一步下降到30-100元/升。因此初期大可不用為培養基的單價太過擔心,同時在選擇好合適的供應商后可以盡早與供應商展開量價談判,明確大規模使用后的價格。